SEPARACIÓN DE MEZCLAS..
viernes, 11 de octubre de 2013
jueves, 10 de octubre de 2013
METODOS DE SEPARACION
En la naturaleza, las sustancias se encuentran formando mezclas y compuestos que es necesario separar y purificar, para estudiar sus propiedades tanto físicas como químicas.
Los procedimientos físicos por los cuales se se paran las mezclas se denominan métodos de separación, que son los siguientes:
DECANTACIÓN: Es la separación mecánica de un sólido de grano grueso, insoluble, en un líquido; consiste en verter cuidadosamente el líquido, después de que se ha sedimentado el sólido. Por este proceso se separan dos líquidos miscibles, de diferente densidad, por ejemplo, agua y aceite.

Diferentes sustancias mostrando su separación por la densidad que poseen
La decantación, es uno de los métodos de separacion de mezclas que sirve para separar solidos de líquidos y líquidos no miscibles. En el primer caso el sólido se sedimenta (por su mayor peso), luego se inclina el recipiente y dejando escurrir el líquido en otro recipiente queda sólo el sólido sedimentado.

También se puede emplear el método del sifón, que consiste en un tubo doblado de tal modo que la rama mas corta se introduce en el líquido de la mezcla ya sedimentada y se aspira por la rama mas larga para hacer el vacio parcial en el interior del tubo, con lo cual la presion atmosferia empuja al líquido separándolo del sedimento.
FILTRACION: Es un tipo de separación mecánica, que sirve para separar sólidos insolubles de grano fino de un líquido en el cual se encuentran mezclados; este método consiste en verter la mezcla a través de un medio poroso que deje pasar el líquido y retenga el sólido. Los aparatos usados se llaman filtros; el más común es el de porcelana porosa, usado en los hogares para purificar el agua. Los medios más porosos mas usados son: el papel filtro, la fibra de vidrio o asbesto, telas etc.
En el laboratorio se usa el papel filtro, que se coloca en forma de cono en un embudo de vidrio, a través del cual se hace pasar la mezcla, reteniendo el filtro la parte sólida y dejando pasar el líquido.

Filtracion con un liquido y un solido
Como material filtrante pueden utilizarse el papel poroso, tejidos de tela, arena fina en capa espesa, el carbón de madera en polvo. Por ejemplo, el colado del café es un proceso de filtración.
EVAPORACIÓN: Es la separación de un sólido disuelto en un líquido, por calentamiento, hasta que hierve y se transforma en vapor. Como no todas las sustancias se evaporan con la misma rapidez, el sólido disuelto se obtiene en forma pura.
El proceso de evaporación consiste en la eliminación de un líquido de una solución, suspensión o emulsión por tratamientos térmicos. Se dice entonces, que la solución, suspensión o emulsión se está concentrando, y para lograr dicho propósito debemos suministrar una fuente de calor externo; esta fuente calórica se logra generalmente con vapor de agua, el cual se pone en contacto con el producto a través de una superficie calefactora. Es una separación de componentes por efecto térmico, en donde se obtienen dos productos de distintas composiciones físico-químicas. En la mayoría de los casos, el producto evaporado, (solvente volátil, que generalmente es agua) es un producto sin valor comercial, mientras que el líquido concentrado, (soluto no volátil) es el que tiene importancia económica. (cabe mencionar que puede suceder al revés). Debemos tener en cuenta que los productos a evaporar se comportan de diferentes formas de acuerdo a su características físico-químicas, las cuales pueden definir un comportamiento de termo sensibilidad, de producir reacciones de precitación, de aglomeración o de polimerización, y un tratamiento inadecuado puede producir un deterioro parcial o total de distintos componentes químicos involucrados en el líquido y de esta forma modificar indeclinablemente las propiedades del mismo. Por esta razón se deben realizar ensayos previos y poder así determinar el equipo adecuado para cada una de las necesidades. Estos ensayos son realizados por ingenieros calificados de nuestra empresa, ya que la misma cuenta con evaporadores a escala de laboratorio y piloto, los cuales permiten determinar variables termodinámicos, coeficientes térmicos, comportamientos en ebullición, grados de ensuciamiento, concentraciones límites y todo lo necesario para asegurar al cliente, un apropiado diseño y construcción de sus equipos.
 |
| Filtracion con un liquido y un solido |
DESTILACIÓN: Es el proceso mediante el cual se efectúa la separación de dos o más líquidos miscibles y consiste en un a evaporación y condensación sucesivas, aprovechando los diferentes puntos de ebullición de cada uno de los líquidos, también se emplea para purificar un liquido eliminando sus impurezas.
En la industria, la destilación se efectúa por medio de alambiques, que constan de caldera o retorta, el refrigerante en forma de serpentín y el recolector; mediante este procedimiento se obtiene el agua destilada o bidestilada, usada en las ámpulas o ampolletas que se usan para preparar las suspensiones de los antibióticos, así como el agua destilada para las planchas de vapor; también de esta manera se obtiene la purificación del alcohol, la destilación del petróleo, etc.
Destilación Simple: es para separar sólidos disueltos en líquidos. Por ejemplo al querer separar la sal (NaCl) del agua, se calienta la mezcla homogénea: el agua se evapora y luego se condensa, y en el recipiente se queda NaCl sólido que no se evapora.
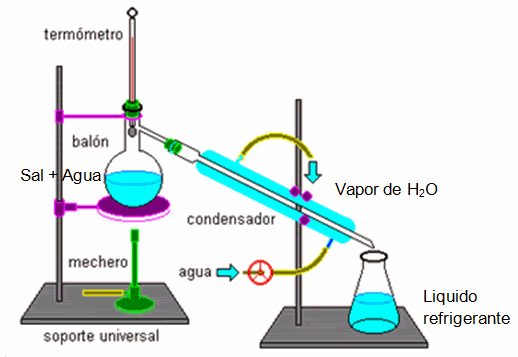 |
| Ejemplo de destilacion simple |
 |
| Destilacion fraccionada del petroleo |
Destilación Fraccionada: Es un proceso físico para separar líquidos miscibles en base a la diferencias de sus puntos de ebullición o condensación. Por ejemplo la mezcla de agua y alcohol (C2H5OH) se calienta. Primero se evapora con mayor rapidez el de menor temperatura de ebullición (T°ebu Alcohol = 78,5 °C) y luego el de mayor temperatura de ebullición (T°ebu Agua = 100°C), luego los vapores se condensan en recipientes separados. Esta operación se lleva a cabo en columnas de fraccionamiento o de rectificación.
CENTRIFUGACIÓN: Proceso mecánico que permite, por medio de un movimiento acelerado de rotación, provocar la sedimentación de los componentes de una mezcla con diferente densidad. Para ello se usa una máquina especial llamada centrífuga. Ejemplo: se pueden separar las grasas mezcladas en los líquidos, como la leche, o bien los paquetes celulares de la sangre, separándolos del suero sanguíneo.La centrifugación es uno de los métodos de separacion de mezclas que puede usarse cuando la sedimentación es muy lenta; para acelerar esta operación la mezcla se coloca en un recipiente que se hace girar a gran velocidad; por acción de la fuerza centrifuga los componentes mas pesados se sedimentan mas rápidamente y los livianos quedan como sobrenadante. Luego la operación que se sigue es la decantación. Centrifugación es un procedimiento que se utiliza cuando se quiere acelerar la sedimentación.
 |
| Cetrifugacion manual |
CRISTALIZACIÓN: Separación de un sólido soluble y la solución que lo contiene, en forma de cristales. Los cristales pueden formarse de tres maneras:
Por fusión: para cristalizar una sustancia como el azufre por este procedimiento, se coloca el azufre en un crisol y se funde por calentamiento, se enfría y cuando se ha formado una costra en la superficie, se hace un agujero en ella y se invierte bruscamente el crisol, vertiendo el líquido que queda dentro. Se observará una hermosa malla de cristales en el interior del crisol.
Por disolución: Consiste en saturar un líquido o disolvente, por medio de un sólido o soluto y dejar que se vaya evaporando lentamente, hasta que se han formado los cristales. También puede hacerse una disolución concentrada en caliente y dejarla enfriar. Si el enfriamiento es rápido, se obtendrán cristales pequeños, y si es lento, cristales grandes.
Sublimación: Es el paso directo de un sólido gas, como sucede con el Iodo y la naftalina al ser calentados, ya que al enfriarse, los gases originan la cristalización por enfriamiento rápido.
Es el proceso mediante el cual se obtienes solidos cristalinos a partir de sus mezclas. Un sólido cristalino posee en su estructura interna un ordenamiento regular de sus partículas (átomos, iones o moléculas) formando figuras geométricas regulares.
 |
| Critalizacion |
En el laboratorio se obtienen por dos caminos:
1. Cristalización por vía húmeda:
Podemos seguir dos procedimientos:
I. Se prepara una solución saturada de cierto sólido que se desea cristalizar, por ejemplo la sal común (NaCl), y se deja reposar en recipientes cilíndricos de vidrio, anchos y bajos llamados cristalizadores.
El disolvente, el agua por ejemplo se evapora y el sólido disuelto cristaliza poco a poco. Esta operación se puede agilizar agregando un sólido inerte insoluble (soporte) o bien introduciendo en el cristalizador una pequeña cantidad del sólido que se desea cristalizar (germen)
II: Se prepara una solución saturada en disolvente caliente, luego de dejar enfriar se obtiene una solución sobresaturada y pronto aparecen los cristales. Este fenómeno ocurre debido a que la solubilidad del sólido a menos temperatura es menor; entonces el exceso que no puede disolverse en el disolvente frio se precipita en forma de solido cristalino. El líquido en el cual se han formado los cristales se conoce como aguas madres.
2. Cristalización por vía seca:
Se puede seguir también mediante dos procedimientos:
I. Se funde (se pasa al estado liquido) el sólido a alta temperatura. Luego se enfría y al solidificarse se forman los cristales, así por ejemplo se obtiene el azufre cristalizado.
II. Ciertos sólidos que fácilmente se subliman (paso de sólido a gas), como gas o vapor se pone en contacto con una superficie fría, y sobre esta se forman los cristales. Así se cristaliza el Iodo y el acido benzoico (C7H6O2)
CROMATOGRAFÍA: Es un procedimiento para separar, identificar y determinar con exactitud la cantidad de cada uno de los componentes de una mezcla.
Son técnicas modernas de separacion de mezclas. Se conocen varias formas como son: cromatografía de columna, de capa delgada, de papel y la cromatografía de gases.
Se fundamenta en el hecho de que algunas sustancias sólidas químicamente inertes y en forma de polvos finos poseen una gran superficie específica (fase estacionaria), caracterizándose por tener la propiedad de fijar o adsorber (fijar en superficie) una gran cantidad de sustancias químicas. Variando el grado de fijación de una sustancia a otra, se logran separar sustancias mezcladas.
Cromatografía de columna:
Consiste en un tubo de vidrio dentro del cual se coloca la sustancia adsorbente (albumina, sílice, carbón vegetal, etc.) que constituye la fase estacionaria y por el extremo superior se adiciona la mezcla de las sustancias que se desea superar; luego se añade un solvente (líquido) apropiado (fase móvil) con el objeto de disolver las sustancias en cuestión y ser arrastradas a lo largo de la columna uno de los componentes quedará absorbido y el otro que no es absorbido quedará disuelto con el líquido. Finalmente por evaporación del solvente se obtendrá una de las mezclas con alto grado de pureza.
 Cromatografía de capa delgada:
En esta técnica se utiliza una sustancia adsorbente la cual se halla extendida en forma regular sobre una placa de vidrio, formando una película delgada. Con la ayuda de un algodón que se empapa con la mezcla que va a ser separada, se coloca en un extremo de la placa, cuidándose de situar dicho extremo boca abajo en contacto con el disolvente.
Este va ascendiendo por la parte seca de la placa en forma lenta, mientras que el absorbente actúa como un secante.
Cuando el disolvente a subido hasta cubrir casi la totalidad del absorbente se retira la placa, se pone a secar y finalmente se trata con un reactivo químico apropiado con el fin de poder revelar las manchas y así poder observarlas. La placa ya revelada se llama cromatograma y muestra las manchas separadas que indican el número de componentes de las mezclas. Cada componente corresponde a una mancha.
Luego para identificar los componentes se toma la distancia desde el origen de la placa a la mancha y se divide por la distancia del origen al frente del disolvente; este cociente se toma como base para la identificación de los componentes por separado, comparando los valores encontrados con el cociente de muestras patrones determinado en condiciones similares.
Cromatografía de capa delgada:
En esta técnica se utiliza una sustancia adsorbente la cual se halla extendida en forma regular sobre una placa de vidrio, formando una película delgada. Con la ayuda de un algodón que se empapa con la mezcla que va a ser separada, se coloca en un extremo de la placa, cuidándose de situar dicho extremo boca abajo en contacto con el disolvente.
Este va ascendiendo por la parte seca de la placa en forma lenta, mientras que el absorbente actúa como un secante.
Cuando el disolvente a subido hasta cubrir casi la totalidad del absorbente se retira la placa, se pone a secar y finalmente se trata con un reactivo químico apropiado con el fin de poder revelar las manchas y así poder observarlas. La placa ya revelada se llama cromatograma y muestra las manchas separadas que indican el número de componentes de las mezclas. Cada componente corresponde a una mancha.
Luego para identificar los componentes se toma la distancia desde el origen de la placa a la mancha y se divide por la distancia del origen al frente del disolvente; este cociente se toma como base para la identificación de los componentes por separado, comparando los valores encontrados con el cociente de muestras patrones determinado en condiciones similares.
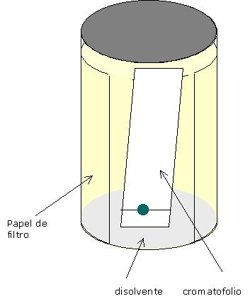
Ejemplo de cromotografia

 |
| Ejemplo de cromotografia |
TAMIZADO: es un método fisico para separar mezclas en el cual se separan dos sólidos formados por partículas de tamaño diferente.
Consiste en hacer pasar una mezcla de partículas de diferentes tamaños por un tamiz, cedazo o cualquier cosa con la que se pueda colar. Las partículas de menor tamaño pasan por los poros del tamiz o colador atravesándolo y las grandes quedan atrapadas por el mismo. Un ejemplo podría ser: si se saca tierra del suelo y se espolvorea sobre el tamiz, las partículas finas de tierra caerán y las piedras y partículas grandes de tierra quedarán retenidas en el tamiz.
Es un método muy sencillo utilizado generalmente en mezclas de sólidos heterogéneos. Los orificios del tamiz suelen ser de diferentes tamaños y se utilizan de acuerdo al tamaño de las partículas de una solución homogénea, que por lo general tiene un color amarillo el cual lo diferencia de lo que contenga la mezcla.
Para aplicar el método de la tamización es necesario que las fases se presenten al estado sólido. Se utilizan tamices de metal o plástico, que retienen las partículas de mayor tamaño y dejan pasar las de menor diámetro. Por ejemplo, trozos de marmol mezclados con arena; harina y corcho; sal fina y pedazos de roca, cantos rodados, etc.
El tamiz de tejido no es más que una serie de hilos colocados a lo ancho y tejido sobre esto en sentido vertical. Lo que están tejidos a lo ancho se llaman trama y los verticales se llaman urdimbre. La forma de hacerlo es pase el hilo de arriba abajo repetidas veces. Entendemos por tamiz cualquier superficie dotada de perforaciones de unas determinadas dimensiones, un tamiz puede ser una chapa perforada un emparrillado o un tejido de tamiz que es en el que nos vamos a centrar:
Características de un tejido de tamiz: según la naturaleza del tamiz que es el material del que están hechos los hilos, pueden ser de acero; Bronce y nylon. Los tamices pueden poseer una diversidad de formas geométricas, pudiendo ser cuadrados, rectangulares, redondos,etc.
 |
| Tamizado de solidos |
LEVIGACION: La levigación es una técnica de separacion de mezclas. Se emplea en la separación de minerales, (material que contiene alta concentración de un mineral) de rocas y tierras de escaso valor industrial (gangas).
La levigación consiste en pulverizar una mezcla sólida y tratarla con disolventes apropiados, basándose en una diferencia de densidad.
 |
| levigacion |
Equipo de Levigación
Por ejemplo en un mineral de la ganga, primero se pulveriza el mineral en bruto (mineral + gangas), luego se coloca la mezcla en un recipiente y se le aplica una corriente de agua. El mineral, por su mayor peso (mayor densidad) queda en el fondo del recipiente y la ganga que flota es arrastrada por el agua.
Otro ejemplo se basa en el principio que se usa en varias preparaciones de la materia prima, como obtener la terra sigillata o bien preparar las arcillas, siendo este uno de los procesos primeros a realizar. Se realiza disolviendo la arcilla en agua, las partículas más finas se quedan en suspensión, mientras que las más pesadas se depositan en el fondo, separándose después, según nuestros intereses.
Ejemplo práctico de levigación:
Al preparar el arroz, colocamos un recipiente de arroz debajo de un chorro con agua, revolvemos con la mano. Se nota que el agua arrastra una sustancia blanca llamada almidón mientras que en el fondo quedan los granos limpios.
IMANTACION: imantacion es pasar un cuerpo la propiedad magnetica del otro,es decir, que ese cuerpo va a atraer magneticamente a otros objetos sin ser por ejemlo un iman..
los materiales imantables son los materiales compuestos con hierro o metal como una aguja, tijeras.....etc Algunos métodos de imantación:
-Frotamiento o contacto directo. Se frota un extremo del material, de acero o hierro, con uno de los polos del imán, y se frota el otro extremo con el otro polo.
-Inducción: Se colocan en las cercanías de un potente imán barras pequeñas de hierro o acero.
-Usando corriente eléctrica: Se enrrolla un cable sobre un trozo de hierro, lo que se conoce como una bobina, que por este método creará un electroimán.
 |
| Ejemplo de inmantacion |
domingo, 22 de septiembre de 2013
Una solucion (o disolucion) es una mezcla de dos o mas componentes, perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales. Esto último significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (solida, liquida o gas) bien definida.
 |
| Mezcla entre dos componentes. Química parteII |
Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Características de las soluciones:
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
III) Los componentes de una solución son soluto y solvente.
SOLUTO: es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
SOLVENTE: es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua.
IV) En una disolución, tanto el soluto como el solvente interactúan a nivel de sus componentes más pequeños (moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la imposibilidad de separar sus componentes por métodos mecánicos.
Se pueden clasificar en :
Diluidas: si la cantidad de soluto respecto del solvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del solvente es grande.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto.
Sobresaturadas: disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas.
MEZCLA.
 |
| Compuestos de diferentes colores,formadas por diferentes compuestos (Ámbito científico-tecnológico nivel II) |
Una mezcla surge cuando se incorporan distintas sustancias, las cuales dan origen a las mezclas homogéneas y mezclas heterogéneas, las cuales se pueden diferenciar por sus propiedades químicas o físicas.
CLASIFICACIÓN DE LAS MEZCLAS:
Mezclas homogéneas: También es conocida como disolución, ( que consiste en un disolvente, en mayor cantidad que el soluto). Las mezclas homogéneas se caracterizan por no distinguirse el soluto y el solvente, es decir,a simple vista solo se ve una sustancia.
 |
| Mezclas homogéneas. Iniciación interactiva de la materia |
Mezclas heterogéneas: Es lo contrario a las mezclas homogéneas, se observan varias fases y no son uniformes. Se clasifican en:
a) Agregados: están formados por partículas sólidas de tamaño más o menos grandes. Sus componentes forman fases que se pueden distinguir a simple vista.
 |
| Ingeniería civil de Honduras. tipos de agregados de concreto |
b) Suspensiones: formadas por un líquido y pequeñas partículas insolubles, las mismas que se asientan al fondo y pueden filtrarse. Por ejemplo, los jugos de frutas, el agua con arena, etc.
 |
| Agua y arena. Clasificación de la materia I |
c) Coloides: Formadas por partículas insolubles dispersas en un medio. Por ejemplo, la gelatina, mayonesa, etc.
En general, las partículas coloidales, según su afinidad o su repulsión por el medio dispersor se clasifican como
- Liófilos (que aman al medio dispersor).
- Liófobos (que odian o rechazan al medio dispersor).
 |
| Gelatina |
Los coloides hidrofobicos solo se pueden preparar en agua si se estabilizan de alguna forma, de lo contrario su falta de afinidad por el agua hace que se separen de ella. Una forma de estabilizar es mediante la absorción de iones en su superficie; estos iones adsorbidos interactúan con el agua y estabilizan el coloide, además la repulsión mutua entre partículas colídales con iones adsorbidos que tiene la misma carga evita que las partículas choquen y se hagan mas grandes
Los coloides hidrofobicos también pueden estabilizarse por la presencia de otras sustancias cuyas moléculas poseen un grupo hidrófobo y un grupo hidrófilo (por ejemplo jabón o detergente), estas sustancias se denominan agentes emulsificantes.
![[agua%2520y%2520aceite%255B4%255D.jpg]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhT13vlI905QelBBMvHCgMIf3XsTDHlSSbOdUx_svScz14rz7CZtJvdvK27cudpCyj2jG5HtkVTtDNl3lOgQdzruD9biroo1n5kMYF7TgmZPlX9gpMh86-6AeRd_5atdGZtyyVWEm9eWjk/s1600/agua%252520y%252520aceite%25255B4%25255D.jpg) |
| Una emulsión de aceite en agua se puede lograr con un poco de jabón. |
Suscribirse a:
Entradas (Atom)



.cmap.jpg)
.jpg)


